Trening hipoksyjny w rehabilitacji pacjentów po przebytej chorobie COVID-19
W organizmie człowieka tlen jest pobierany z powietrza w pęcherzykach płucnych, gdzie około 95% dostarczanego do układu naczyń włosowatych tlenu wiąże się z hemoglobiną. Serce pompuje utlenioną krew do wszystkich organów, co ma kluczowe znaczenie dla prawidłowego funkcjonowania narządów, ze szczególnym uwzględnieniem procesów metabolicznych na poziomie komórkowym. Fizjologicznie hipoksja jest stanem, podczas którego tlen nie jest dostarczany w wystarczającej ilości do tkanek organów, co w konsekwencji prowadzi do niedotlenienia. Organizm człowieka wykształcił więc mechanizmy adaptacyjne umożliwiające walkę z niskim wysyceniem krwi tlenem. Nagłe zmiany saturacji krwi tlenem są wykrywane przez kłębek szyjny (łac. glomus caroticum) – mały narząd znajdujący się w rozwidleniu tętnicy szyjnej wspólnej, który koordynuje natychmiastową odpowiedź organizmu na niedotlenienie. Kłębek szyjny kontroluje pracę kanałów jonowych wrażliwych na tlen, co na poziomie komórkowym prowadzi do szeregu zmian związanych z pobudliwością i funkcjami wydzielniczymi komórek kłębka szyjnego. Gdy poziom tlenu spada, wysyłane są sygnały zamykające kanały potasowe, co prowadzi do depolaryzacji błony i wydzielenia neuroprzekaźników, które następnie stymulują przekazywanie sygnału do ośrodka oddechowego w rdzeniu przedłużonym, co powoduje hiperwentylację, skurcz tętnic oraz zwolnienie akcji serca.
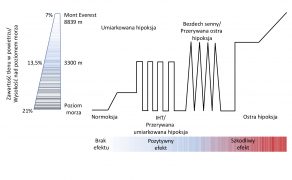
Dotychczasowe badania dotyczące molekularnych podstaw odpowiedzi komórkowej na hipoksję, sugerują wysoce obiecujący potencjał zastosowania metody opartej na wykorzystaniu umiarkowanej i kontrolowanej hipoksji na fizjologię organizmu człowieka. Stosowanie cyklicznej, przerywanej i umiarkowanej hipoksji jest terapią stosunkowo prostą, bezpieczną, niosącą ze sobą ogromny potencjał terapeutyczny dla wielu schorzeń i może być częścią normalnej fizjologii. Umiarkowana hipoksja nie powinna być błędnie mylona z przewlekłą i ostrą hipoksją, która niesie ze sobą negatywne skutki (ryc. 1). Zastosowanie terapii umiarkowaną, przerywaną hipoksją wygeneruje długoterminową odpowiedź organizmu, aktywując ekspresję czynników transkrypcyjnych indukowanych niedotlenieniem (HIFs – ang. hypoxia-inducible factors), które z kolei zwiększają ekspresję genów kodujących białka odpowiedzialne za utrzymanie homeostazy tlenu i ułatwiające adaptację komórek do hipoksji. To spowodowało, że w ostatnich latach wzrosło zainteresowanie skutkami adaptacyjnymi wywołanymi poprzez krótkotrwałe i przerywane ekspozycje na obniżony poziom tlenu.
Stabilizacja czynnika HIF – badania
Warto nadmienić, że zasługi dla zrozumienia procesów kontrolujących adaptację do hipoksji zostały nagrodzone w 2019 Nagrodą Nobla w dziedzinie medycyny i fizjologii dla Brytyjczyka Petera J. Ratcliffe’a (Oxford University) i dwóch Amerykanów: Williama G. Kaelina Jr (Harvard University) oraz Gregga L. Semenzy (John Hopkins University). W swoich badaniach opisali oni, w jaki sposób brak dostępnego tlenu aktywuje szlak sygnałowy oparty na stabilizacji HIF, który reguluje transkrypcje setek genów kodujących białka, biorących udział w różnych procesach biologicznych, między innymi w proliferacji komórkowej, angiogenezie, metabolizmie oraz regulacji odpowiedzi immunologicznej. W warunkach, gdy wymagana ilość tlenu jest dostępna, HIF jest nieaktywny. Reszty prolinowe podjednostek HIF-α są hydroksylowane za pomocą zależnych od tlenu hydroksylaz 4-prolilowych (PHDs). Następnie ligaza ubikwityny E3 (białko von Hippel – Lindau (pVHL)), wiąże się z uhydroksylowaną formą czynnika HIF-α, co prowadzi do natychmiastowej degradacji proteosomalnej białka HIF. Dodatkowo reszty asparaginowe podjednostek HIF-α są również hydroksylowane przez czynniki hamujące HIF (FIH). Modyfikacja ta hamuje wiązanie HIF z koaktywatorami p300 / CREB, które jest wymagane do pełnej aktywności szlaku. W warunkach niedotlenienia (hipoksji), hydroksylacja HIF-α jest zahamowana w wyniku inaktywacji enzymów PHDs i FIH, których aktywność jest zależna od obecności tlenu. Prowadzi to do stabilizacji i akumulacji HIF-α, który następnie jest translokowany do jądra komórkowego, gdzie wiąże się z HIF-1β (HIF1B). Heterodimeryczny kompleks czynnika transkrypcyjnego HIF-α: HIF-1β przyłącza się do genomu, gdzie zlokalizowany jest element odpowiedzi na hipoksję (HRE) i zapoczątkowuje transkrypcje szerokiej gamy zależnych od niego genów, generując odpowiedź na hipoksję, działając w zasięgu ustrojowym (zwiększona erytropoeza, zwiększenie częstości oddechów, wydolności pracy serca), zasięgu lokalnym (stymulacja angiogenezy, waskulogenezy) oraz na poziomie komórkowym (stymulacja glikolizy, promowanie proliferacji komórkowej).



















![Wybrane aspekty fizjoterapii wad postawy [E-BOOK]<br />
<br />
<br />](https://rehabilitacjawpraktyce.pl/wp-content/uploads/sites/12/2024/03/RWP_wybrane_aspekty_fizjoterapii_wad_postawy_1200x1200.png)